公司工学院侯仰龙教授课题组长期致力于低维磁性纳米材料的设计合成,研究反应条件、表面结构、界面能等因素对材料成核与生长的影响规律,探索其界面结构、电子结构及微磁学结构与材料表观性能之间的构效关系,进而在维度、尺寸、形貌、结晶性和异质界面等多个方面实现协同调控。最近,为了进一步利用碳化铁纳米颗粒的生物酶活性,侯仰龙教授团队报道了一种基于肿瘤微环境“解锁”的具有纳米酶活性的多功能磁性纳米诊疗探针Ag2S@Fe2C-DSPE-PEG-iRGD,成果发表于Science Advances(Sci. Adv. 2020, 6, eabc8733)。
近年来,过渡金属碳化物纳米结构引起了研究人员的广泛关注,特别是碳化铁纳米材料,因其较高的饱和磁化强度、优异的稳定性、高效的催化活性以及良好的生物相容性等特点,在纳米磁学、费托合成催化、电化学能源存储与转换以及生物医学领域具有重要的应用潜力。目前的碳化铁制备方法繁琐,常常采用成本高、形貌难以控制、操作也较繁复的高温固相反应或者激光热分解等技术。2012年,侯仰龙教授课题组在碳化铁 (Fe5C2) 的可控制备及其费托合成催化性能研究方面取得了重要突破,其首次在相对温和的条件下 (623 K, 0.1 MPa),液相制备出了形貌可控的Fe5C2纳米颗粒,解决了目前碳化铁存在的制备方法繁琐,常常采用成本高、形貌难以控制和操作较繁复等问题。相关工作2012年发表在Journal of the American Chemical Society 杂志(J. Am. Chem. Soc. 2012, 134, 15814-15821)。
该Fe5C2磁性纳米颗粒具有独特的物理化学性质和优异的生物相容性,在生物医学中具有巨大的应用潜力。随后,侯仰龙教授组建科研团队进行深入研究。经过多年的不懈努力,团队围绕“分子影像诊疗探针”这一新兴的医工交叉领域,发展了一系列磁性纳米探针,取得重要研究进展。
2014年,侯仰龙教授团队率先在国际上提出碳化铁纳米颗粒体系,利用其磁、光、声、热等方面的独特性质,构建了第一个基于Fe5C2纳米颗粒的靶向卵巢癌的新型磁性纳米诊疗探针Fe5C2-ZHER2:342。该磁性纳米探针具有高饱和磁化强度,可以作为优异的磁共振成像造影剂。此外,该磁性纳米探针还具有良好的光吸收能力,展现出优异的光声成像能力和光热性能。该磁性纳米探针可以实现磁共振成像和光声成像介导的卵巢癌光热治疗。该成果于2014年发表在Advanced Materials上(Adv. Mater. 2014, 26, 4114-4120)。
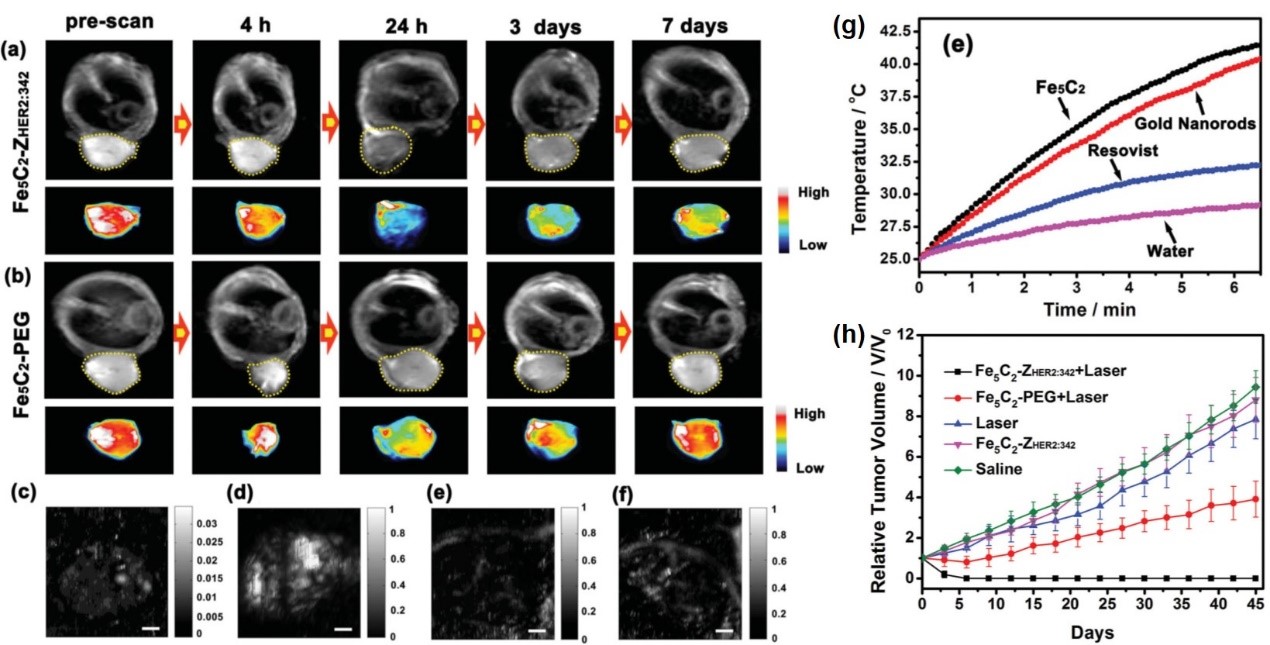
图1. Fe5C2-ZHER2:342磁性纳米探针在活体水平的磁共振成像,光声成像和光热治疗评价
用于癌症治疗的智能药物递送系统在肿瘤治疗领域具有重要的意义。然而,开发具有早期诊断、可控药物递送和可生物降解的智能药物递送系统仍然面临巨大的挑战。2016年,侯仰龙教授团队利用Fe5C2磁性纳米颗粒构建了一种刺激性响应型的智能磁性纳米诊疗探针Fe5C2-BSA-DOX。利用Fe5C2纳米颗粒的磁靶向功能远程调控肿瘤部位的富集,在肿瘤酸性微环境和近红外光刺激下实现药物可控释放,进而实现卵巢癌的化疗和光热治疗的协同治疗。该成果于发表于ACS Nano上(ACS Nano 2016, 10, 159-169)。
随后,为了进一步拓展碳化铁纳米颗粒的性能,课题组创新性地引入金元素合成了一种单分散Au-Fe2C双面纳米颗粒。通过功能化修饰,构建了一种新型的磁性纳米诊疗探针Au-Fe2C-ZHER2:342。该磁性纳米探针在近红外区域具有光谱光吸收特性,体外808nm光辐射的光热转换效率可以达到30.2%,是一种理想的光热治疗纳米制剂。结合该材料的磁性特征,实现了磁共振成像/光声成像/CT三模式成像引导下的乳腺癌光热治疗。该成果于2017年发表于ACS Nano上(ACS Nano 2017, 11, 9239-9248)。
为了进一步提高智能纳米诊疗探针的载药率,侯仰龙教授团队将Fe/FeO磁性纳米颗粒、吲哚菁绿和阿霉素依次包裹于温敏型聚乳酸-羟基乙酸共聚物的衍生化合物PLGA-PEG-PNIPAM(PPP)中,设计了一种在近红外光和肿瘤微环境双重刺激下尺寸可收缩的智能磁性纳米诊疗探针DOX-ICG@Fe/FeO-PPP-FA,实现了磁共振成像和荧光成像双模态成像介导的人口腔表皮样癌的化疗、光热治疗和化学动力学治疗的联合治疗。该成果于2019年发表于Nature Communications上(Nat. Commun. 2019, 10, 4418)。
生命活动和机体代谢过程都是通过生物催化来完成的,其中主要是酶催化的各种生化反应。自2007年发现四氧化三铁纳米材料具有类似辣根过氧化物酶的催化特性以来,纳米酶研究领域迅速崛起。纳米酶作为一种模拟天然酶活性的人工酶,在肿瘤治疗中受到广泛关注。然而,如何设计出在肿瘤中保持其活性而对周围正常组织无毒副作用的纳米酶仍然面临巨大的挑战。近年来,侯仰龙教授团队开发了一系列的磁性纳米颗粒,也开始考虑对这些纳米探针的类生物酶活性进行进一步揭示,并将其应用于肿瘤的诊疗研究。2019年,研究团队设计并合成了一种基于Fe5C2@Fe3O4磁性纳米颗粒的活性氧反应器PEG/ Fe5C2@Fe3O4作为肿瘤诊疗磁性纳米探针。该纳米酶可以通过磁靶向实现肿瘤部位的靶向定位和富集。在肿瘤微环境的弱酸性和高过氧化氢含量的刺激下,该纳米酶可以释放Fe2+触发芬顿反应,从而上调肿瘤细胞内活性氧水平诱导细胞凋亡,实现乳腺癌的杀伤。此外,核磁共振成像中T2/T1信号转变可有效监测Fe2+释放和活性氧产生情况。该成果发表于ACS Nano上(ACS Nano 2019, 13, 10002-10014)。
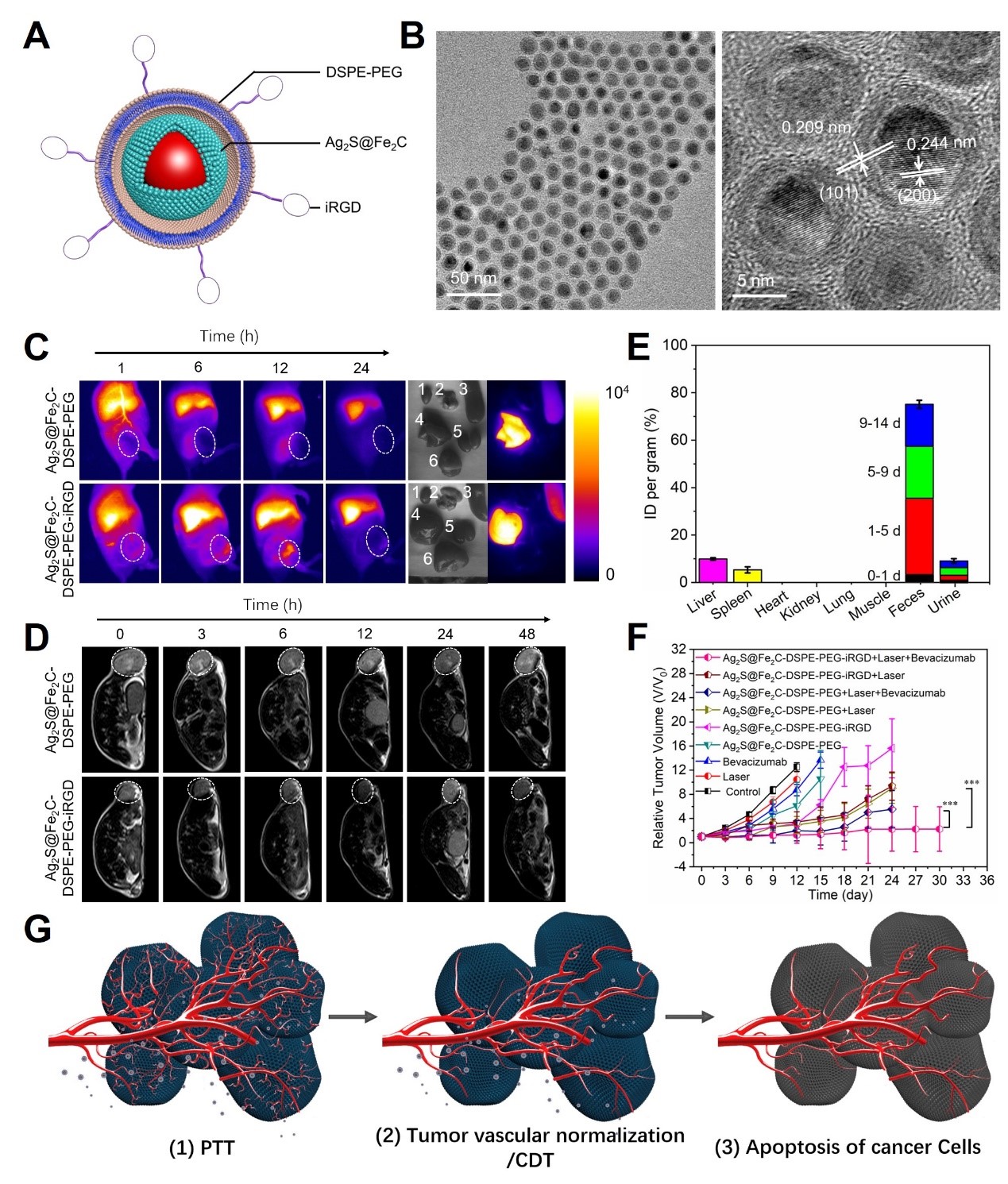
图2. Ag2S@Fe2C-DSPE-PEG-iRGD磁性纳米诊疗探针示意图(A)、纳米酶透射电镜表征(B)、纳米酶的活体NIR-II荧光成像评价(C)、纳米酶的活体磁共振成像评价(D)、纳米酶的生物代谢评价(E)、乳腺癌联合治疗效果评价(F)和基于纳米酶与肿瘤血管正常化结合的乳腺癌联合治疗策略示意图(G)
最近,为了进一步利用碳化铁纳米颗粒的生物酶活性,侯仰龙教授团队还报道了一种基于肿瘤微环境“解锁”的具有纳米酶活性的多功能磁性纳米诊疗探针Ag2S@Fe2C-DSPE-PEG-iRGD。开发的这种纳米酶不仅具有光热性质,而且在肿瘤微环境的刺激下能有效地产生活性氧。该纳米酶在近红外二区荧光成像和磁共振成像中也显示出了优异的成像性能,可用于体内可视化追踪。通过与肿瘤血管正常化的贝伐珠单抗进行联合,展现出对乳腺癌显著的治疗效果(图1)。该成果于2020年发表于Science Advances(Sci. Adv. 2020, 6, eabc8733)。相关链接:https://advances.sciencemag.org/content/advances/6/48/eabc8733.full.pdf。
相关工作感谢国家重点研发计划(2017YFA0206301),国家自然科学基金委重点项目(51631001)、创新群体(81421004)、面上项目(51672010)和北京市自然科学基金-海淀原始创新联合基金(L172008)资助。